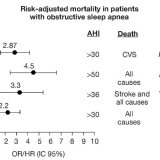
Metabolismo glucidico
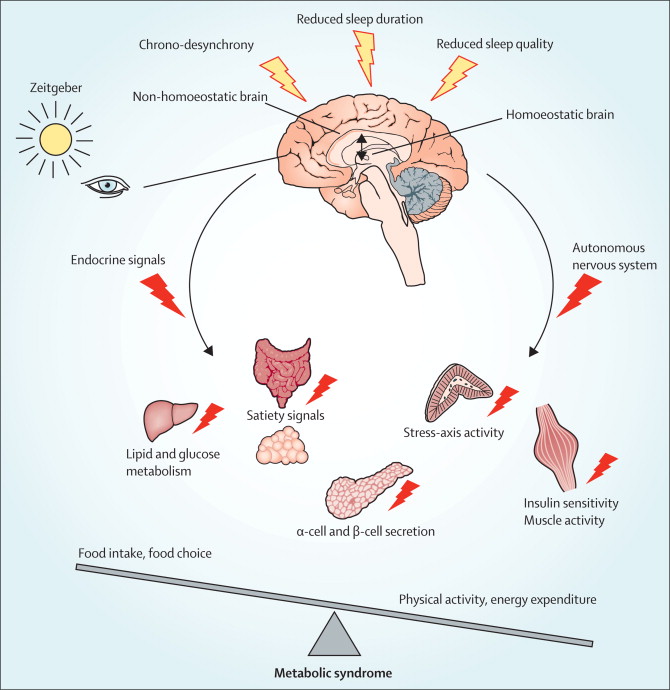
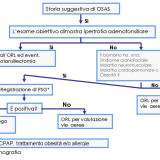
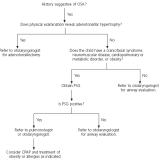
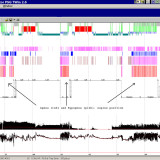
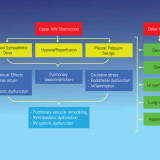
Negli ultimi anni numerosi studi hanno portato all’attenzione i rapporti tra alterazioni del sonno e del metabolismo glucidico, dimostrando in particolare che la deprivazione di sonno può dar luogo ad un aumento dell’insulinoresistenza. Un aumento dell’insulinoresistenza è stato riportato dalla maggior parte degli studi anche nei pazienti con Sindrome delle Apnee Ostruttive Notturne (OSAS). In questi ultimi, però, non è alterata la durata totale del sonno ma la sua struttura, tipicamente frammentata e con una ridotta percentuale degli stadi del sonno più profondo. Se la frammentazione del sonno e la sua deprivazione hanno effetti simili, alla frammentazione del sonno potrebbe essere attribuito un ruolo come fattore determinante le alterazioni del metabolismo osservate nell’OSAS. Stamatakis e Punjabi nel loro studio hanno voluto verificare se la frammentazione del sonno, indotta artificialmente in soggetti sani, possa provocare acutamente alterazioni del metabolismo glucidico, e se insieme ad esse possano comparire variazioni del bilancio simpatovagale, ormonali o di indici infiammatori. Undici soggetti sani, buoni dormitori, sono stati sottoposti a tre notti consecutive di monitoraggio polisonnografico: la prima di controllo, e le successive due durante somministrazione ripetuta di stimoli acustici e meccanici che provocavano un forte aumento della frequenza di arousal, senza ridurre la durata totale del sonno. Inoltre, nel giorno precedente la prima ed in quello successivo all’ultima polisonnografia sono stati eseguiti un ECG della durata di 5 minuti, un test di tolleranza al glucosio per via venosa e determinazioni ormonali e di marker di infiammazione. Gli effetti osservati sono stati: una riduzione della sensibilità all’insulina associata a variazioni di altri indici che esprimevano una riduzione della capacità di smaltimento del glucosio; un aumento della risposta acuta insulinica al glucosio stesso; variazioni delle frequenze spettrali elettrocardiografiche sia diurne, sia notturne, espressione di aumento dell’attività nervosa simpatica; non variazioni significative di citochine infiammatorie e adipochine; aumento della cortisolemia. Frammentazione e deprivazione del sonno potrebbero dunque avere effetti analoghi su almeno alcuni aspetti del metabolismo glucidico. Trasponendo questi risultati all’OSAS, gli autori propongono che la frammentazione del sonno possa essere responsabile di insulinoresistenza in questa patologia, e che questo effetto possa essere mediato da un aumento dell’attività simpatica e del cortisolo. Prima di questo studio, autori dello stesso gruppo avevano già pubblicato due importanti lavori: in uno di questi venivano descritte, in soggetti normali sottoposti per alcune ore ad ipossia intermittente, alterazioni dei meccanismi di smaltimento del glucosio (dipendenti o no dall’azione o dalla sensibilità all’insulina) analoghe a quelle dimostrate in questo studio, ed anch’esse associate ad un aumento dell’attività simpatica [Louis M, Punjabi NM. J Appl Physiol 2009;106:1538–1544]; nell’altro lavoro, eseguito su pazienti con OSA, venivano riportate alterazioni dei meccanismi di smaltimento del glucosio nell’OSA in parte correlate alla frequenza degli arousal ed in parte alla gravità dell’ipossia notturna [Punjabi NM, Beamer BA. Am J Respir Crit Care Med 2009;179:235–240]. Nell’insieme, quindi, i lavori di Punjabi e coll. supportano un’azione congiunta nell’OSA di ipossia intermittente e frammentazione del sonno nell’alterare i meccanismi di smaltimento del glucosio, mediata almeno in parte da un aumento dell’attività simpatica. Sia l’ipossia intermittente, sia la frammentazione del sonno potrebbero esercitare i loro effetti acutamente, poiché le loro conseguenze nei soggetti sani sono state osservate in tempi molto brevi. Questo dato ben si accorda con i risultati di altri studi che hanno mostrato un aumento della sensibilità all’insulina dopo solo pochi giorni di trattamento dell’OSA, senza ulteriori variazioni in tempi successivi. [Harsch IA et al. Am J Respir Crit Care Med 2004;169:156-62; Lam JCM et al. Eur Respir J 2010;35:138–145]. Fino a che punto questo aumento possa essere attribuito a variazioni dell’attività simpatica resta dubbio. Infatti, secondo alcune osservazioni una riduzione del tono simpatico col trattamento dell’OSA tende a rendersi evidente progressivamente nei mesi che seguono l’inizio della terapia [Narkiewicz K et al. Circulation 1999;100:2332-2335], a differenza di quanto osservato a carico della sensibilità all’insulina negli studi sopra citati. Inoltre esperimenti su animali hanno dimostrato un effetto dell’ipossia intermittente nell’aumentare l’insulinoresistenza indipendente dall’attività simpatica [Ilyori N et al. Am J Respir Crit Care Med 2007;175:851-857]. I dati del lavoro sono quindi importanti nell’indicare la possibilità di un effetto acuto della frammentazione del sonno sul metabolismo glucidico, che può intervenire anche nell’OSA. E’ verosimile comunque che la patogenesi e le modalità temporali di insorgenza dell’insulinoresistenza nell’OSA siano molto complesse e che ad essa contribuiscano diverse concause, non ancora ben conosciamo.